
افسانهای خاموش، سالهاست در کلاسها و کتابها زمزمه میشود—چنان آرام و چنان فراگیر که کمتر کسی در صحتش تردید میکند. این افسانه میگوید: آنتروپی یعنی بینظمی. یعنی گسترش آشوب. یعنی فروریختن نظم کیهانی.
اما اگر این باور، با همهی شهرتش، ناقص باشد چه؟
اگر آنتروپی، نه پایان نظم، بلکه الگوی پنهانیِ شکلگیریِ نظم باشد چه؟
من نیز، همچون بسیاری دیگر، سالها در این برداشت نادرست سرگردان بودم—تا زمانی که نشانههایی از واقعیتی ژرفتر نمایان شد. بر خلاف آنچه گفتهاند، آنتروپی در مورد بینظمی نیست؛ آنتروپی در مورد هندسه است—هندسهای ناپیدا، از جنس اطلاعات.
اما هندسه چیست؟ بیش از خط و زاویه و دایره است. هندسه، معماریِ واقعیت است. قانونیست که بر فضا حکم میراند: بر فاصلهها، جهات، موقعیتها. بدون هندسه، جهان به بیفرمی فرو میغلتد—نه آزادی، بلکه خلأی بیمعنا.
و با این حال، هر جا که چشم میدوزیم، نظم هندسی را میبینیم. سیارهها سرگردان نمیچرخند؛ با دقتی بینقص در مدارهایی بیضیوار حرکت میکنند. کوهها با تقارنهای طبیعی قد علم میکنند. و حیات—از DNA خاموش گرفته تا شاخههای مغز بیدار—همه در نظمی شگفت جریان دارند.
در پس این جلوهها، عناصر بنیادین—کربن، هیدروژن، اکسیژن و دیگران—در روابطی پیچیده اما دقیق با یکدیگر میرقصند؛ هندسهای ناپیدا که جهان ما را میسازد. ما قواعد جهان را، از دل همین هندسه، بیرون میکشیم.
و اینجاست که آنتروپی وارد میشود. نه برای نابود کردن نظم، بلکه برای اندازهگیری آن.
بیایید به یک مولکول آشنا نگاه کنیم: ایبوپروفن. وقتی این دارو سنتز میشود، دو تصویر آینهای از آن پدید میآید. از نظر شیمیایی یکساناند، اما تنها یکی در بدن انسان اثر دارد. چرا؟ چون گیرندههای بدن ما «دستسان» هستند—جهتمندند، و فقط یکی از آن دو تصویر در چارچوب هندسهی زیستی جا میافتد. طبیعت، بیسروصدا، هندسه را ترجیح میدهد.
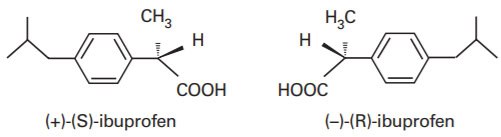
و این، تنها قطرهایست از اقیانوس. تمام زیستشناسی ما وابسته به پیکربندیهای دقیق ماده است. و این دقیقاً همان چیزیست که آنتروپی آن را ثبت میکند.
در زبان دقیقتر، «هندسه»ی یک سامانه، یعنی ساختار فضای حالت آن—مجموعهی تمام حالتهایی که میتواند در آنها قرار گیرد. حتی در سادهترین سامانهها نیز این هندسه پیداست. مسئلهی سهجسمی را تصور کنید: حرکت سه جرم در فضای گرانشی، با نظمی عجیب و ظاهراً بیقاعده. اما اگر دقیقتر بنگری، میبینی که راهحلهای پایدار، از هندسهی قوانین نهفته در سامانه نشئت میگیرند.
آنتروپی فقط یک عدد ثابت نیست که همیشه بالا برود. بلکه نقشهایست از همهی حالتهای ممکن. میگوید در یک ناحیه از فضای حالت، چند ریزحالت وجود دارد. بهعبارتی، حجمِ امکانات را میشمارد.
برای فهم آنتروپی، باید پرسید: در این سامانه، محتملترین توزیع چیست؟ پاسخ این است: توزیعی که بیشترین آنتروپی را دارد. آنتروپی، تابعیست که یک توزیع را میگیرد و عددی بازمیگرداند که پیچیدگی آن را توصیف میکند. و این توزیع، حاصلِ قوانین و قیود سامانه است
تصور کن یک ستون بلند پر از گاز داریم—مثلاً یک محفظهی شیشهای عمودی که پایین آن روی سطح زمین است. در غیاب هر قانون یا نیرویی، انتظار داریم که مولکولهای گاز بهطور یکنواخت در تمام ارتفاع محفظه پخش شوند؛ هرجایی ممکن است یک مولکول باشد. توزیع، یکنواخت و بیتفاوت است.
اما حالا نیروی گرانش وارد میشود.
گرانش یک قاعدهی جدید به سیستم اضافه میکند: مولکولهایی که به بالا میروند باید انرژی بیشتری داشته باشند. در نتیجه، بیشتر مولکولها در پایین تجمع میکنند، جایی که انرژی پتانسیل کمتر است. و در ارتفاعات بالا، چگالی گاز بهطرز چشمگیری کاهش مییابد.
بهعبارت دیگر، توزیع احتمال حضور یک مولکول در فضا، دیگر یکنواخت نیست—بلکه وابسته به ارتفاع و انرژی است. این همان توزیع بولتزمن است. این توزیع نشان میدهد که هرچه بالا میرویم، احتمال یافتن مولکول کمتر میشود. و این هندسهای در فضای حالت ایجاد میکند که از دل قوانین فیزیکی (گرانش و ترمودینامیک) پدیدار شده است.
در نهایت، پرسش واقعی این نیست که آنتروپی چیست؛ بلکه این است که شکلِ امکانها در این جهان، چه شکلیست؟
و اگر آن شکل را بیابیم… هندسهی هستی را یافتهایم.