در دنیای شیمی معدنی، طبقهبندی مواد به عنوان اسید یا باز قوی و ضعیف، یکی از مفاهیم بنیادی است که گاهی اوقات حتی دانشجویان و صنعتگران را نیز دچار تردید میکند. یکی از سوالاتی که بسیار جستجو میشود این است: باریم هیدروکسید باز قوی است یا ضعیف؟
پاسخ به این سوال نه تنها برای حل مسائل شیمی، بلکه برای درک نحوه واکنش این ماده در فرآیندهای صنعتی و آزمایشگاهی (مانند تیتراسیون) بسیار حیاتی است. در این مطلب، با نگاهی دقیق به ساختار مولکولی و رفتار شیمیایی باریم هیدروکسید، به این سوال پاسخ میدهیم.
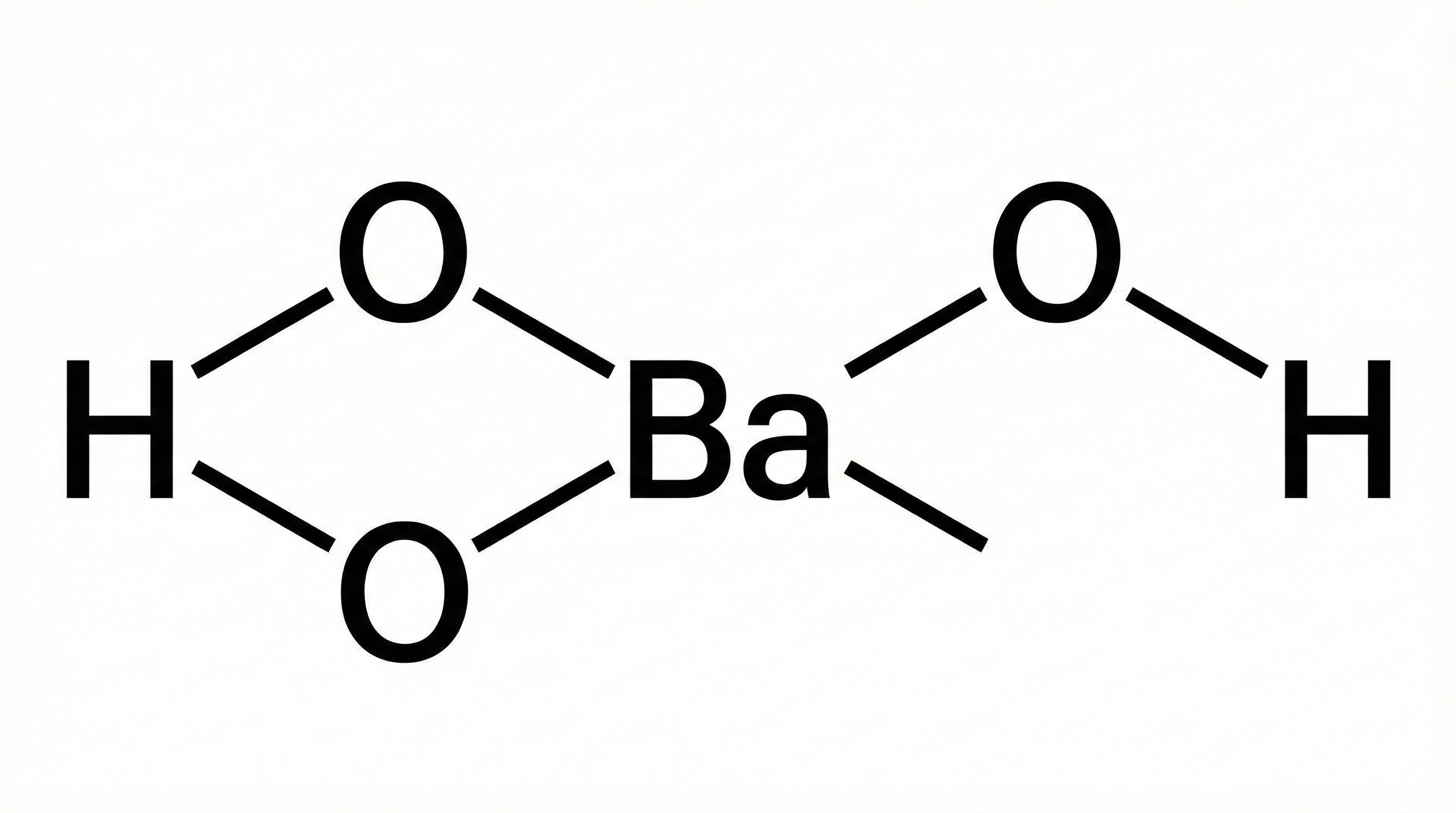
بله، باریم هیدروکسید ($Ba(OH)_2$) یک باز قوی است. شاید برایتان سوال پیش بیاید که چرا برخی منابع در مورد حلالیت آن صحبت میکنند و این موضوع باعث سردرگمی میشود. نکته کلیدی اینجاست که در شیمی، قدرت یک باز با میزان حلالیت آن متفاوت است.
تعریف یک باز قوی بر اساس توانایی آن در تفکیک (یونیزاسیون) کامل در آب است. هیدروکسیدهای فلزات گروه ۱ (فلزات قلیایی) و فلزات سنگینتر گروه ۲ (فلزات قلیایی خاکی) مانند باریم، وقتی در آب حل میشوند، به طور کامل یونهای هیدروکسید ($OH^-$) خود را آزاد میکنند.
معادله تفکیک باریم هیدروکسید در آب به صورت زیر است:
$$Ba(OH)_2 (aq) \rightarrow Ba^{2+} (aq) + 2OH^- (aq)$$
همانطور که در معادله بالا میبینید، فلش واکنش یکطرفه است. این یعنی مولکولهای حل شده به طور ۱۰۰٪ به یونهای سازندهشان تبدیل میشوند و هیچ مولکول خنثیای در محلول باقی نمیماند. همین ویژگی باعث میشود که pH محلولهای باریم هیدروکسید بسیار بالا (بسیار قلیایی) باشد.
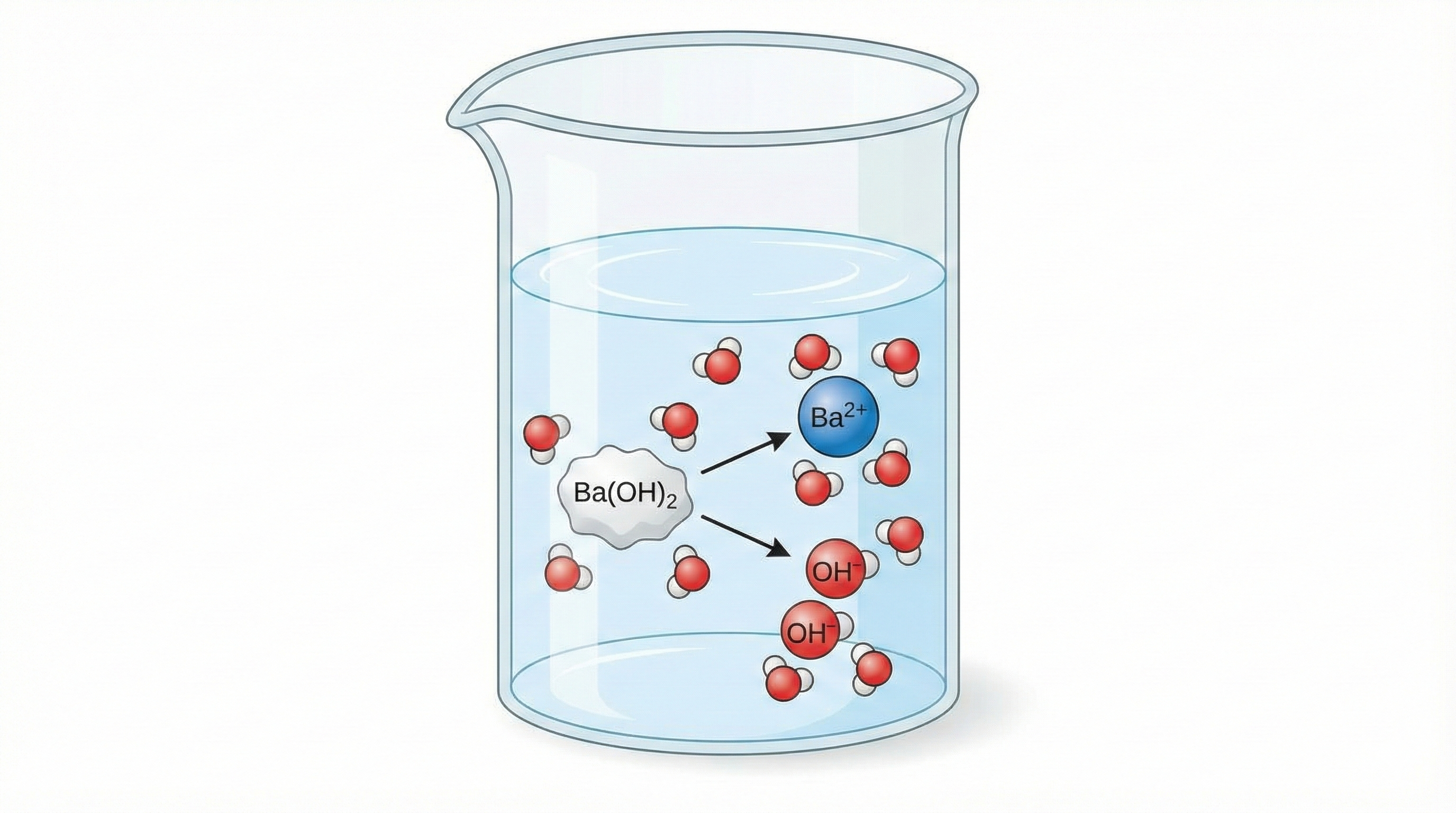
یک نکته انحرافی که اغلب باعث اشتباه میشود، مسئله حلالیت است.
باریم هیدروکسید در مقایسه با سدیم هیدروکسید (سود پرک)، حلالیت کمتری در آب دارد.
اما، هر مقداری از آن که در آب حل شود، کاملاً یونیزه میشود.
بنابراین، حتی اگر محلول اشباع شده آن غلظت کمتری نسبت به سایر بازها داشته باشد، باز هم به عنوان یک الکترولیت قوی و یک باز قوی رفتار میکند.

دانستن اینکه باریم هیدروکسید یک باز قوی است، هشدارهای ایمنی خاصی را میطلبد. بازهای قوی خاصیت خورندگی شدیدی دارند.
آسیب پوستی: تماس این ماده با پوست میتواند باعث سوختگیهای شیمیایی شدید شود.
آسیب چشمی: پاشیده شدن محلول آن در چشم بسیار خطرناک است و میتواند به قرنیه آسیب جدی برساند.
سمیت باریم: علاوه بر خاصیت بازی، خود یون باریم نیز برای بدن سمی است و میتواند بر عملکرد قلب و ماهیچهها اثر بگذارد.
بنابراین، هنگام کار با این ماده در آزمایشگاه یا صنعت، استفاده از دستکش، عینک ایمنی و روپوش الزامی است.
به دلیل خاصیت قلیایی قوی، این ماده کاربردهای ویژهای دارد:
تیتراسیون اسیدهای ضعیف: به خصوص اسیدهای آلی.
سنتز آلی: به عنوان کاتالیزور یا واکنشدهنده.
تصفیه آب: برای حذف ناخالصیهای سولفات.
باریم هیدروکسید قطعا یک باز قوی است. این ماده در آب به طور کامل تفکیک شده و دو یون هیدروکسید آزاد میکند. اگرچه حلالیت آن محدود است، اما رفتار شیمیایی آن کاملاً منطبق بر تعاریف بازهای قوی (مانند NaOH و KOH) میباشد.
اگر برای خط تولید خود به دنبال خرید مواد شیمیایی صنعتی با خلوص بالا و تضمین کیفیت هستید، حتماً با کارشناسان رز تجارت سمیر تماس بگیرید. برای اطلاعات بیشتر به سایت رز تجارت مراجعه نمایید.