استاد راهنما: دکتر صادق علیاکبری
محقق: مهدی تیموریان
دانشکده: دانشکده مهندسی کامپیوتر دانشگاه شهید بهشتی سال ۱۴۰۳
علم شبکههای پیچیده و کانکتومیکس با بهرهگیری از نظریه گراف، تحلیل اختلالات شبکهای و یادگیری ماشین تحول چشمگیری در درک سیستمهای زیستی و عصبی ایجاد کردهاند. این مطالعه نشان میدهد که چگونه شبکههای متابولیکی و مغزی با داشتن ویژگیهای دنیای کوچک، ماژولاریتی و سازماندهی سلسلهمراتبی امکان مدلسازی پیشبینانه برای تشخیص و درمان بیماریها را فراهم میکنند. در علوم اعصاب، تحلیل کانکتوم اختلالات شبکهای در بیماری آلزایمر را شناسایی کرده و آن را از پیری طبیعی متمایز میسازد. بهطور مشابه، تحلیل شبکههای متابولیکی مسیرهای کلیدی بیوشیمیایی را برای کشف دارو و پزشکی دقیق تعیین میکند. با یکپارچهسازی دادههای چندمقیاسی و مدلسازی محاسباتی، این حوزهها روشی قدرتمند برای تشخیص زودهنگام، کشف بیومارکرها و مداخلات درمانی ارائه میدهند.
مغز انسان با حدود ۸۶ میلیارد نورون و بیشمار سیناپس که شبکهای وسیع از ارتباطات را شکل میدهند، یکی از پیچیدهترین ساختارهای شناختهشده در علم به شمار میآید. درک چگونگی شکلگیری فرایندهای شناختی، حافظه و رفتار از میان این ارتباطات پیچیده، همچنان یکی از بزرگترین چالشهای علوم اعصاب است. روشهای سنتی عموماً برای تحلیل چنین ساختار عظیمی کافی نیستند؛ ازاینرو، به کارگیری روشهای محاسباتی برای کشف الگوها در این شبکه عظیم ضروری میباشد.
در این میان، پیشرفتهای صورتگرفته در علوم کامپیوتر و نظریه شبکههای پیچیده، ابزارها و مدلهای قدرتمندی را برای ترسیم، مصورسازی، و تحلیل دادههای اتصال در سیستم عصبی فراهم آوردهاند. با مدلسازی مغز بهعنوان گرافی متشکل از گرهها (نورونها یا نواحی مغزی) و یالها (سیناپسها یا مسیرهای ارتباطی)، پژوهشگران میتوانند با استفاده از الگوریتمهای مختلفی نظیر اندازهگیری مراکز مهم (Centrality) و تشخیص خوشهها (Community Detection)، ساختارهای کلیدی شبکه را شناسایی و الگوهای درونی و گستردهای را کشف کنند که زیربنای فرایندهای شناختی و رفتاری است.
این همگرایی بین کانکتومیکس و تحلیل شبکههای پیچیده نهتنها به فهم عمیقتر کارکردهای سالم مغز کمک میکند، بلکه زمینهساز شناخت بهتر اختلالات عصبی نیز میشود. برای نمونه، بههمریختگی در ساختار توپولوژیک شبکه مغزی سبب بروز بیماریهایی همچون آلزایمر، اسکیزوفرنی و صرع میشود. رویکرد مبتنی بر شبکه در بررسی این اختلالات، شناسایی نشانگرهای زیستی (Biomarkers) و تدوین راهکارهای درمانی را تسهیل میکند.
مطالعه نقشه مغز امکان میدهد تا هابهای کلیدی را در ساختار اتصالات مغزی شناسایی کنیم؛ هابهایی که اطلاعات را در میان چندین ناحیه مغزی یکپارچه و توزیع میکنند. همچنین این رویکرد به کشف ساختارهای ماژولاری میانجامد که نواحی مغزی مرتبط به لحاظ عملکردی را در کنار هم قرار میدهد. با محاسبه معیارهایی مانند مرکزیت گره، ضریب خوشهبندی و طول مسیر، میتوان تعیین کرد کدام نواحی در انتقال سیگنالهای عصبی بیشترین نقش را ایفا میکنند. این دیدگاه نشان میدهد که ماژولهای تخصصی مغز چگونه با یکدیگر در ارتباط هستند و فرایندهای محلی به چه صورت از عملکردهای شناختی کلی حمایت میکنند.
با وجود پیشرفتهای قابل توجه در روشهای تصویربرداری و بازسازی، دستیابی به یک کانکتوم کامل از مغز انسان همچنان دور از دسترس است و دلیل آن، نیاز فوقالعاده بالا به توان پردازشی و فضای ذخیرهسازی است. در یک کانکتوم با وضوح بالا، باید میلیاردها نورون و تریلیونها سیناپس نقشهبرداری شوند که حجمی در حد پتابایت (یا حتی اگزابایت) داده را تولید میکند. پردازش این دادهها، از قطعهبندی و همترازسازی گرفته تا تحلیل نهایی، همگی به منابع عظیم محاسباتی و زمان بسیار طولانی نیاز دارند که حتی ابررایانههای مدرن نیز با مشکل روبرو میشوند. زیرساخت ذخیرهسازی و پهنای باند لازم برای مدیریت، بایگانی و اشتراک این دادهها در میان پژوهشگران نیز چالش دیگری است. در نتیجه، ساخت یک کانکتوم کامل در سطح سیناپس برای کل مغز انسان فراتر از توانمندیهای فعلی فناوری است.
نوروآناتومی به مطالعه ساختار و دستگاه عصبی میپردازد و بررسی میکند که چگونه نورونها و سیناپسها در قالب مدارهای پیچیده شکل میگیرند. در کانکتومیکس، این مدارها در سطوح مختلف (از نورونهای منفرد در سطح میکروسکوپی تا ناحیههای وسیع در سطح ماکروسکوپی) نقشهبرداری میشوند. تصاویری که از طریق میکروسکوپ الکترونی یا روشهایی مانند تصویربرداری پخششی (Diffusion MRI) به دست میآیند، جزئیات ظریفی از اتصالات نورونی را نمایش میدهند. این دادهها سپس بازسازی میشوند تا کانکتوم را شکل دهند و نقشه جامعی از اتصالات مغز ارائه دهند. بررسی این نقشهها راهی برای درک پیوند بین ساختار مغز و عملکردهای آن فراهم میکند.
در علوم اعصاب، دادههای حاصل از تصویربرداری یا رکوردهای الکتریکی، اغلب به ساختارهای ریاضی یا محاسباتی تبدیل میشوند. یکی از معمولترین این روشها، استفاده از ماتریسهای مجاورت است که در آن سطرها و ستونها نشاندهنده نورونها یا نواحی مغزی و مقادیر درون ماتریس نشاندهنده ارتباطات آنها هستند. گاهی نیز از نمودار گراف برای نشان دادن گرهها (نورونها یا مناطق مغزی) و یالها (اتصالات) استفاده میشود. در صورت وجود دادههای کمی، میزان قدرت یا نوع اتصال به صورت وزن روی یال ثبت میشود. این شیوه نمایش داده، تحلیل شبکهای و مقایسه الگوهای متفاوت کانکتومها را تسهیل میکند.
شبکههای پیچیده، سیستمهایی با تعداد زیادی مؤلفه در حال تعامل هستند که از دید نظریه گراف مورد مطالعه قرار میگیرند. در این تحلیل، معیارهایی مانند درجه (Degree)، ضریب خوشهبندی (Clustering Coefficient)، و متریکهای مرکزیت (نظیر Betweenness یا Eigenvector) برای بررسی ساختار شبکه استفاده میشوند. روشهای شناسایی جامعه (Community Detection) نیز برای یافتن خوشههای متراکم گرهها کاربرد دارند که وجود زیرساختارها یا ماژولهای وظیفهای در مغز را تایید میکنند. در شبکههای دینامیک، این شاخصها در طول زمان ردیابی میشوند تا تغییرات و روندهای شبکه بررسی شوند و بتوان رفتار آینده را پیشبینی کرد.
تبدیل دادههای MRI به یک کانکتوم معمولاً با تعریف نواحی مغزی مورد علاقه (ROI) بر اساس یک اطلس آناتومیکی یا عملکردی آغاز میشود. برای ساخت کانکتوم ساختاری، از دادههای تصویربرداری پخششی (diffusion MRI) استفاده میشود تا مسیرهای الیاف مادهسفید با کمک الگوریتمهای تراکتوگرافی بازسازی گردند. سپس وزن هر یال برحسب تعداد یا تراکم تراکتهای بین جفت ناحیههای مغزی تعیین شده و ماتریس مجاورت به دست میآید. در کانکتوم عملکردی، از fMRI استفاده میشود و پس از استخراج سیگنال زمانی هر ROI، شاخصهای شباهت (مانند ضریب همبستگی) میان این سیگنالها محاسبه میگردد. سرانجام، این ماتریسها که نشاندهنده میزان ارتباط ساختاری یا عملکردی میان ناحیههای مختلف هستند، به عنوان کانکتوم در نظر گرفته میشوند.
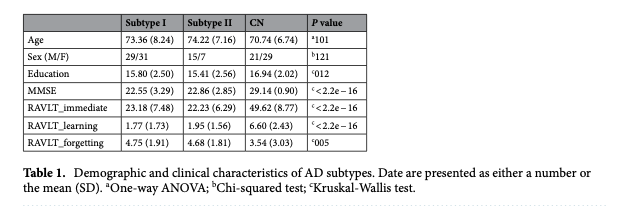
این مطالعه بر شناسایی زیرگونههای بیماری آلزایمر (AD) بر اساس اتصال عملکردی مغز (FC) تمرکز دارد و از تکنیکهای خوشهبندی و تحلیل نظریه گراف استفاده میکند. پژوهش، یک خودرمزگذار مبتنی بر خوشهبندی سلسلهمراتبی را برای دستهبندی بیماران آلزایمر بر اساس الگوهای اتصال عملکردی آنها پیشنهاد میدهد.
شناسایی دو زیرگونه بیماری آلزایمر بر اساس اتصال عملکردی:
تحلیل شبکهای مغز با استفاده از نظریه گراف:
بررسی اتصال عملکردی و مدژولار بودن شبکه در آلزایمر:
استفاده از خودرمزگذار برای کاهش ابعاد در تحلیل شبکه مغز:
تأثیر سن و نمرات شناختی بر ساختار شبکهای:
این پژوهش رویکردی مبتنی بر شبکههای پیچیده برای درک سازماندهی ساختاری و عملکردی مغز در بیماری آلزایمر ارائه میکند. در این راستا، شبکه تشابه رادیومیکس منطقهای (R2SN) معرفی شده است که شبکههای تشابه مورفولوژیکی را از دادههای MRI استخراج میکند. این شبکه قادر است تغییرات سلسلهمراتبی ظریف در بیماری آلزایمر را که با روشهای سنتی قابل تشخیص نیستند، شناسایی کند.
گرادیانهای توپولوژیکی مغز و اختلالات آنها
تفاوتهای شبکهای عملکردی و ساختاری بین آلزایمر و پیری طبیعی
ارتباط گرادیانهای مغزی با امضاهای مولکولی
استفاده از شبکههای پیچیده برای تشخیص زیستی آلزایمر
این مقاله نشان میدهد که شبکههای متابولیکی از متابولیتهای درهمتنیده تشکیل شدهاند که مسیرهای بیوشیمیایی پیچیدهای را ایجاد میکنند. این شبکهها دارای ویژگیهای دنیای کوچک، ماژولاریتی و ساختارهای سلسلهمراتبی هستند که مشابه سایر شبکههای زیستی و اجتماعی میباشند.
مدلهای شبکه و معیارهای تحلیل:
مکانیسمهای بیماری و اختلالات شبکهای:
پیشبینی و تشخیص از طریق نشانگرهای زیستی مبتنی بر شبکه:
کشف دارو از طریق تحلیل شبکههای متابولیکی:
آینده علم شبکههای پیچیده و علوم کانکتوم در مسیر تحول درک ما از سیستمهای زیستی قرار دارد، بهویژه با بهرهگیری از مدلهای پیشرفته شبکهای، یکپارچهسازی دادههای چندمقیاسی، و تحلیلهای مبتنی بر هوش مصنوعی. کانکتومیکس، بهویژه در علوم اعصاب، از یک نمایش ایستا از اتصالهای مغزی به یک چارچوب پویا و چندلایه تغییر جهت داده است که تعاملات بیوشیمیایی، ساختاری و عملکردی را در نظر میگیرد. تحقیقات آینده احتمالاً بر مدلسازی پیشبینانه متمرکز خواهد بود، جایی که رویکردهای شبکههای پیچیده میتوانند پیشبینیهایی درباره پیشرفت بیماری، انعطافپذیری عصبی، و عملکرد شناختی ارائه دهند. با ظهور بیومارکرهای مبتنی بر شبکه، تشخیص زودهنگام بیماریهایی مانند آلزایمر و اختلالات متابولیکی با دقت بیشتری انجام خواهد شد و از این طریق، پزشکی شخصیسازیشده با تحلیل کانکتوم هر فرد تسهیل میشود.
تا به امروز، این حوزهها از نظریه گراف، یادگیری ماشین و پردازش دادههای حجیم بهشدت بهرهمند شدهاند. مدلسازی متابولیکی مبتنی بر گراف به کشف داروها کمک شایانی کرده و امکان شناسایی گرههای کلیدی در مسیرهای بیوشیمیایی را فراهم آورده است که در نتیجه، درمانهای هدفمندتری توسعه یافتهاند. بهطور مشابه، در علوم اعصاب، یکپارچهسازی تصویربرداری fMRI، دادههای ژنتیکی و تحلیل شبکههای انتقالدهنده عصبی الگوهای اتصال مغزی متمایزی را آشکار کرده است که بیماریهای نورودژنراتیو را از روند پیری طبیعی تفکیک میکند. پیشرفتهایی در حوزه نقشهبرداری پخشی (Diffusion Map Embedding)، تحلیل مرگ سلولی مصنوعی (Synthetic Lethality Analysis)، و تئوری کنترلپذیری شبکه (Network Controllability Theory) به درک عمیقتر از نحوه حفظ پایداری و سازگاری سیستمهای زیستی در برابر اختلالات منجر شده است. در آینده، ترکیب میان شبکههای پیچیده، هوش مصنوعی و بیوانفورماتیک احتمالاً منجر به استراتژیهای درمانی نوین، بهینهسازی روشهای توانبخشی عصبی و اصلاح مدلهای محاسباتی هوش خواهد شد.
تقاطع علم شبکههای پیچیده و کانکتومیکس پیشرفتهای چشمگیری در درک سیستمهای زیستی و عصبی، بهویژه در زمینههای پیشبینی، تشخیص و راهکارهای درمانی بیماریها ایجاد کرده است. با بهرهگیری از نظریه گراف، تحلیل اختلالات شبکهای و یادگیری ماشین، پژوهشگران توانستهاند روابط پیچیدهای را در شبکههای متابولیکی و عصبی شناسایی کنند که نشان میدهد چگونه اختلال در این سیستمها به بیماریهایی مانند آلزایمر، سرطان و سندرمهای متابولیکی منجر میشود. یکپارچهسازی مدلهای شبکهای چندمقیاسی، شامل دادههای ژنومی، پروتئومیک و متابولومیک، دیدگاهی جامعتر از مکانیسمهای بیماری ارائه داده است و از رویکردهای سنتی تقلیلگرایانه فراتر رفته است.
در آینده، تحقیقات در حوزه علم شبکههای زیستی و پزشکی با پیشرفت در مدلسازی محاسباتی، تحلیلهای مبتنی بر هوش مصنوعی و پزشکی دقیق شکل خواهد گرفت. توانایی نقشهبرداری، تحلیل و اصلاح شبکههای پیچیده زیستی نه تنها موجب بهبود تشخیص زودهنگام بیماریها میشود، بلکه مداخلات درمانی هدفمندتری را با کارایی بالاتر امکانپذیر میکند. در علوم اعصاب، تغییر رویکرد از مدلهای تحلیل موضعی تخریب مغزی به رویکردهای شبکهای گسترده چارچوبی جامعتر برای درک زوال شناختی و اختلالات مغزی ارائه خواهد داد. بهطور مشابه، در تحقیقات متابولیکی، کشف داروهای جدید مبتنی بر شبکه باعث اصلاح و بهینهسازی راهکارهای درمانی از طریق شناسایی آسیبپذیریهای کلیدی متابولیکی خواهد شد. با پیشرفت این حوزههای میانرشتهای، همافزایی میان علم شبکههای پیچیده، بیوانفورماتیک و هوش مصنوعی مرزهای جدیدی را در تحقیقات پزشکی باز خواهد کرد و در نهایت منجر به راهکارهای درمانی شخصیسازیشده و مؤثرتر خواهد شد.